Μάθημα : ΧΗΜΕΙΑ Γ' ΓΥΜΝΑΣΙΟΥ
Κωδικός : 2901010217
-
Θεματικές Ενότητες
-
Μάθημα 16: Οι υδρογονάνθρακες - Ονοματολογία
-
Μάθημα 15: Οι υδρογονάνθρακες - Γενικά - Ταξινόμηση
-
Μάθημα 14: Ο άνθρακας
-
Μάθημα 13 : Τα αλκάλια
-
Μάθημα 12 : Γιατί υπάρχουν χημικά στοιχεία με παρόμοιες ιδιότητες;
-
Μάθημα 11: … στο σήμερα: Ο σύγχρονος περιοδικός πίνακας - Τα μέταλλα και τα αμέταλλα στον περιοδικό πίνακα
-
Μάθημα 10: Ο Περιοδικός Πίνακας - Από το χθες . . .
-
Μάθημα 9: Εφαρμογές των οξέων, βάσεων και αλάτων στην καθημερινή ζωή
-
Μάθημα 8: Τα άλατα
-
Μάθημα 7: Eξουδετέρωση
-
Μάθημα 6: Η κλίμακα του pH ως μέτρο βασικότητας - Η κλίμακα του pH
-
Μάθημα 5: H κλίμακα pH (πε-χα) ως μέτρο της οξύτητας - To pH του καθαρού νερού
-
Μάθημα 4: Ιδιότητες των βάσεων - Βάσεις κατά Arrhenius
-
Μάθημα 3: Οξέα κατά Arrhenius
-
Μάθημα 2: 1.1 Ιδιότητες των οξέων (β)
-
Μάθημα 1: 1.1 Ιδιότητες των οξέων (α)
-
ΕΠΑΝΑΛΗΨΗ 2 - Η χημική εξίσωση
-
ΕΠΑΝΑΛΗΨΗ 1 : Άτομα- Μόρια - Ιόντα
-
Μάθημα 16: Οι υδρογονάνθρακες - Ονοματολογία
Μάθημα 4: Ιδιότητες των βάσεων - Βάσεις κατά Arrhenius
Μάθημα 4
2.1 Ιδιότητες των βάσεων (σελ. 21)
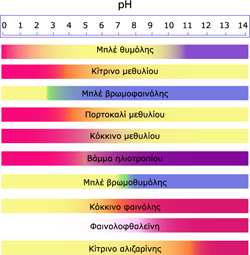
Στο χημικό εργαστήριο χρησιμοποιούνται μια σειρά από δείκτες όπως το μπλε της θυμόλης, το κίτρινο του μεθυλίου, τη φαινολοφθαλεΐνη.
Οι δείκτες αυτοί είτε είναι ουσίες που παρασκευάζονται εξολοκλήρου από τους χημικούς ή παραλαμβάνονται από εκχύλιση φυτών.
Συνήθως στο χημικό εργαστήριο ο όρος «δείκτες» αναφέρεται στα διαλύματά τους. Το χρώμα που παίρνει ένα διάλυμα μιας ουσίας αν προστεθεί σε αυτό μερικές σταγόνες δείκτη είναι ενδεικτικό για το αν η ουσία είναι οξύ ή βάση.
Πολλές φορές προστίθενται μερικές σταγόνες δείκτη σε απεσταγμένο νερό και στη συνέχεια προστίθεται η ουσία ή το διάλυμά της.
Στο σχήμα δίνονται τα ονόματα μερικών από αυτούς και τα χρώματα που έχουν σε όξινα, ουδέτερα και βασικά διαλύματα,
2.2 Βάσεις κατά Arrhenius (σελ. 21 -22)
Παρακολουθείστε ένα βίντεο που δείχνει πως τα μόρια του νερού διασπούν τα μόρια του υδροξειδίου του νατρίου σε ιόντα υδροξειδίου και νατρίου.
Απλοί κανόνες ονοματολογίας των βάσεων
Ο γενικός μοριακός τύπος των βάσειων είναι Μ(ΟΗ)x όπου Μ είναι το μέταλλο, ΟΗ είναι το υδροξείδιο και x το φορτίο του μετάλλου χωρίς το πρόσημο του.
Τα ονόματα των βάσεων είναι της μορφής "Υδροξείδιο του Μετάλλου".
Παραδείγματα
NaOH: υδροξείδιο του νατρίου που διαλυμένο στο νερό διίσταται σε ένα κατιόν Na+και ένα ανιόν ΟΗ-
ΚΟΗ: υδροξείδιο του καλίου που διαλυμένο στο νερό διίσταται σε ένα κατιόν Κ+και ένα ανιόν ΟΗ-
Ca(OH)2 : υδροξείδιο του ασβεστίου που διαλυμένο στο νερό διίσταται σε ένα κατιόν Ca+2και δύο ανιόντα ΟΗ-
Βa(OH)2 : υδροξείδιο του βαρίου που διαλυμένο στο νερό διίσταται σε ένα κατιόν Βa+2 και δύο ανιόντα ΟΗ-
Al(OH)3 : υδροξείδιο του αργιλίου που διαλυμένο στο νερό διίσταται σε ένα κατιόν Al+3 και τρία ανιόντα ΟΗ-
Εξαίρεση στον παραπάνω κανόνα είναι η αμμωνία (NH3 ). Η αμμωνία δεν έχει στο μόριο της υδροξείδιο. Όταν όμως διαλυθεί στο νερό ελευθερώνονται ανιόντα υδροξειδίου σύμφωνα με την αντίδραση:
NH3 + Η2Ο → NH4+ + OH-
Εργασία για το σπίτι:Η άσκηση που ακολουθεί.
Πηγές υλικού: " Ο Θαυμαστός κόσμος της Χημείας για το Γυμνάσιο", https://ts.sch.gr/repo/online-packages/gym-chimeia-b-c/chemistry/common/people/people.htm