Μάθημα : ΧΗΜΕΙΑ Γ' ΓΥΜΝΑΣΙΟΥ
Κωδικός : 2901010217
-
Θεματικές Ενότητες
-
Μάθημα 16: Οι υδρογονάνθρακες - Ονοματολογία
-
Μάθημα 15: Οι υδρογονάνθρακες - Γενικά - Ταξινόμηση
-
Μάθημα 14: Ο άνθρακας
-
Μάθημα 13 : Τα αλκάλια
-
Μάθημα 12 : Γιατί υπάρχουν χημικά στοιχεία με παρόμοιες ιδιότητες;
-
Μάθημα 11: … στο σήμερα: Ο σύγχρονος περιοδικός πίνακας - Τα μέταλλα και τα αμέταλλα στον περιοδικό πίνακα
-
Μάθημα 10: Ο Περιοδικός Πίνακας - Από το χθες . . .
-
Μάθημα 9: Εφαρμογές των οξέων, βάσεων και αλάτων στην καθημερινή ζωή
-
Μάθημα 8: Τα άλατα
-
Μάθημα 7: Eξουδετέρωση
-
Μάθημα 6: Η κλίμακα του pH ως μέτρο βασικότητας - Η κλίμακα του pH
-
Μάθημα 5: H κλίμακα pH (πε-χα) ως μέτρο της οξύτητας - To pH του καθαρού νερού
-
Μάθημα 4: Ιδιότητες των βάσεων - Βάσεις κατά Arrhenius
-
Μάθημα 3: Οξέα κατά Arrhenius
-
Μάθημα 2: 1.1 Ιδιότητες των οξέων (β)
-
Μάθημα 1: 1.1 Ιδιότητες των οξέων (α)
-
ΕΠΑΝΑΛΗΨΗ 2 - Η χημική εξίσωση
-
ΕΠΑΝΑΛΗΨΗ 1 : Άτομα- Μόρια - Ιόντα
-
Μάθημα 16: Οι υδρογονάνθρακες - Ονοματολογία
Μάθημα 5: H κλίμακα pH (πε-χα) ως μέτρο της οξύτητας - To pH του καθαρού νερού
Μάθημα 5
1.3 H κλίμακα pH (πε-χα) ως μέτρο της οξύτητας (σελ. 16)
1.4 To pH του καθαρού νερού (σελ. 16 -17)
Ξέρουμε ότι το σύνολο των κοινών ιδιοτήτων των διαλυμάτων των οξέων ονομάζεται όξινος χαρακτήρας.
Όμως τις παραπάνω ιδιότητες όλα τα οξέα δεν της έχουν στον ίδιο βαθμό.Για παράδειγμα, όλα τα ροφήματα που καθημερινά καταναλώνονται και είναι όξινα διαλύματα (π.χ. το γάλα που περιέχει γαλακτικό οξύ, ο χυμός του λεμονιού κιτρικό οξύ, το κρασί τρυγικό οξύ κ.τ.λ.), δεν είναι το ίδιο ξινά. Άλλα από αυτά είναι περισσότερο και άλλα λιγότερο ξινά.
Επίσης όλα τα οξέα δεν αντιδρούν το ίδιο έντονα με τα μέταλλα και το μάρμαρο (CaCO3 ). Τέλος όταν αραιωθεί ένα διάλυμα οξέος, δηλαδή προστεθεί σε αυτό νερό, τότε ο όξινος χαρακτήρας του γίνεται λιγότερο έντονος. Για παράδειγμα αν αραιωθεί το ξίδι γίνεται λιγότερο ξινό.
Την ένταση με την οποία εκδηλώνεται ο όξινος χαρακτήρας τη λέμε και οξύτητα.
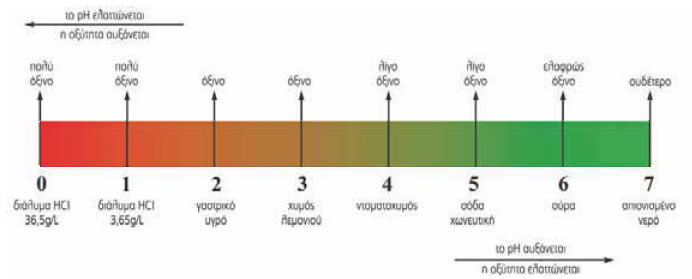
Έτσι συνηθίζεται ένα διάλυμα οξέος να χαρακτηρίζεται ως ελαφρώς όξινο, λίγο όξινο, όξινο ή πολύ όξινο ανάλογα με την οξύτητά του.
Η οξύτητα ενός διαλύματος μπορεί να μετρηθεί με την κλίμακα του ρΗ (πεχα). Στην κλίμακα αυτή, τα διαλύματα των οξέων παίρνουν τιμές από 0 έως 7.
Όσο πιο μικρή είναι η τιμή του pH, τόσο μεγαλύτερη είναι η οξύτητα του διαλύματος.
 Έχει διαπιστωθεί πειραματικά ότι ένα πάρα πολύ μικρό ποσοστό των μορίων του νερού (μόνο τέσσερα στο ένα δισεκατομύριο) διίστανται στα ιόντα από τα οποία αποτελείται σύμφωνα με την παρακάτω χημική εξίσωση:
Έχει διαπιστωθεί πειραματικά ότι ένα πάρα πολύ μικρό ποσοστό των μορίων του νερού (μόνο τέσσερα στο ένα δισεκατομύριο) διίστανται στα ιόντα από τα οποία αποτελείται σύμφωνα με την παρακάτω χημική εξίσωση:
Η2Ο → Η+ + ΟΗ-
Πιο συγκεκριμένα το νερό κατά τη διάσταση του δίνει κατιόντα υδρογόνου, H+ , και ανιόντα OH- , τα οποία ονομάζονται υδροξείδια.
Από την ίδια χημική εξίσωση προκύπτει επίσης ότι τα κατιόντα υδρογόνου που παράγονται από τα μόρια του νερού είναι ίσα με τα ανιόντα υδροξειδίου.
Έτσι, στο καθαρό νερό (δηλαδή στο νερό που δεν περιέχει καμία διαλυμένη ουσία) ισχύει:
πλήθος Η+= πλήθος ΟΗ-
Η περιεκτικότητα ενός διαλύματος σε κατιόντα υδρογόνου εκφράζεται όμως με έναν αριθμό, το pH του διαλύματος.
Εφόσον και στο καθαρό νερό περιέχονται κατιόντα υδρογόνου, συμπεραίνουμε ότι και στο καθαρό νερό αντιστοιχεί κάποια τιμή pH:
Το pH του καθαρού νερού είναι 7 (στους 25o C).
Το ίδιο pH με το καθαρό νερό (pH = 7) έχουν και όλα τα υδατικά διαλύματα στα οποία ισχύει η σχέση (1) στους 25o C. Τα διαλύματα αυτά ονομάζονται ουδέτερα.
1.5 Το pH των όξινων διαλυμάτων (σελ. 17)
Όπως είδαμε, όταν ένα οξύ διαλύεται στο νερό, παρέχει κατιόντα υδρογόνου. Επομένως, στα διαλύματα των οξέων τα ιόντα Η+ θα είναι περισσότερα από τα ιόντα ΟΗ-. Έτσι:
σε κάθε διάλυμα οξέος ισχύει: πλήθος Η+(aq) > πλήθος ΟΗ-(aq)
Η πρόταση αυτή είναι ισοδύναμη με την πρόταση σε κάθε διάλυμα οξέος ισχύει: pH < 7
Στην προσομοίωση που ακολουθεί θα παρατηρήσουμε πώς μεταβάλλεται το pH των όξινων διαλυμάτων όταν προσθέτουμε νερό (δηλαδή τα αραιώνουμε) ή αντίθετα, όταν προσθέτουμε πυκνό οξύ (τα συμπυκνώνουμε)
Επισημάνσεις
- Όταν προσθέτουμε νερό σε ένα όξινο διάλυμα (δηλαδή όταν το αραιώνουμε) το διάλυμα γίνεται λιγότερο όξινο, γιατί σε ορισμένο όγκο διαλύματος περιέχονται λιγότερα H+. Επομένως, το pH του διαλύματος αυξάνεται.
-
Συμπύκνωση ενός διαλύματος ονομάζεται η αύξηση της περιεκτικότητας του με αφαίρεση νερού ή με προσθήκη διαλυμένης ουσίας. Στην περίπτωση αυτή το διάλυμα γίνεται περισσότερο όξινο, γιατί σε ορισμένο όγκο διαλύματος περιέχονται περισσότερα H+. Επομένως, το pH του διαλύματος μειώνεται.
- Όσο νερό και αν προσθέσουμε σε ένα όξινο διάλυμα, το διάλυμα θα παραμείνει όξινο, δηλαδή το pH του θα είναι πάντα μικρότερο από 7.
Εργασία για το σπίτι:Η άσκηση που ακολουθεί.
Πηγές υλικού: " Ο Θαυμαστός κόσμος της Χημείας για το Γυμνάσιο", https://ts.sch.gr/repo/online-packages/gym-chimeia-b-c/chemistry/common/people/people.htm